오늘은 많은 분들이 궁금해 하는 프로바이오틱스 L. acidophilus YT1(락토바실러스 아시도필루스 YT1)의 갱년기 증상 완화 효과에 대해 전임상 실험 연구 실험 자료를 조금이라도 이해를 돕기 위해 정보를 준비했습니다.

갱년기 동물모델(Lactobacillus acidophilus YT1의 감쇠 효과 난소절제술을 받은 쥐의 갱년기 증상)에서 Lactobacillus acidophilus YT1의 갱년기 증상 완화 효과
현대 의학 기술과 경제 수준의 향상으로 인해 우리 사회는 점점 고령화되고 있습니다. 통계청에 따르면 1970년에는 여성의 평균 기대수명이 65.6세였지만 2015년에는 크게 증가하여 85.2세까지 올랐습니다. 이에 따라 여성들은 폐경 후의 수명도 증가하며, 이로 인해 폐경 후 건강관리에 대한 관심도 계속해서 증가하고 있습니다.
폐경 후 여성은 난소 기능 소실로 인해 자연스럽게 갱년기 증상을 경험하게 됩니다. 이러한 변화는 신체적인 변화뿐만 아니라 감정적인 변화도 동반됩니다. 주요한 갱년기 증상으로는 홍조, 야간 땀, 기억력 감퇴, 우울증, 수면 장애, 비만, 통증 과민 등이 있으며, 골다공증, 간 질환, 심혈관 질환 등 다양한 질병의 발병 위험도 증가합니다.
기존의 갱년기 증상 완화를 위해 호르몬 대체 요법(HRT)이 많이 사용되었지만, 장기간 사용 시 심혈관 질환, 유방암, 관상동맥성 심장병, 뇌졸중, 난소암 등의 질병 발생 위험이 증가하므로 부작용이 적은 새로운 접근법의 개발이 필요하였습니다. 이에 식물성 에스트로겐인 석류 추출물이나 백하수오 등이 갱년기 증상 완화에 도움이 될 수 있다는 연구 결과가 보고되었습니다.
또한 프로바이오틱스는 세계보건기구에서 “적당량 섭취 시 숙주에게 건강상 유익한 효과를 주는 살아있는 미생물”로 정의되며, 소화 기능 개선, 피부 건강 증진, 면역력 강화, 콜레스테롤 저하 등 다양한 영역에서 건강 개선 효능이 보고되고 있습니다. 특히 유산균인 Lactobacillus acidophilus는 유제품 제조에 사용되는 유산균 중 하나로 널리 알려져 있으며, 아토피피부염, 천식과 같은 알레르기 질환 개선에도 도움을 준다고 알려져 있습니다.
최근의 연구에서는 갱년기 동물모델에서 L. acidophilus의 투여가 골밀도 개선, 통증 과민, 체지방 증가, 우울증 등 다양한 갱년기 증상 완화에 효과가 있다는 사실이 밝혀졌습니다.
따라서 본 연구에서는 난소절제 동물모델에서 신규 프로바이오틱스 후보 균주인 L. acidophilus YT1의 투여가 갱년기 증상 개선에 어떠한 효과가 있는지 확인하고자 합니다.
갱년기 모델에서의 통증 민감도 변화 측정
본 실험에서는 갱년기 동물 모델에 대하여 12주 동안 다양한 처리를 시행한 후 통증 민감도를 측정하였습니다. 결과적으로, Sham 그룹에 비해 OVX 그룹에서는 통계적으로 유의한 통증 민감도의 증가가 관찰되었습니다(P<0.01). 그러나 estradiol 투여 그룹과 L. acidophilus YT1 투여 그룹에서는 OVX 그룹에 비해 통증 민감도의 감소가 유의적으로 나타났습니다(P<0.001). 이는 L. acidophilus YT1의 투여가 갱년기 증상 중 통증 민감도를 감소시키는데 효과적임을 시사합니다.
갱년기 여성들을 대상으로 한 통증 민감도 측정 연구에서는 통증 민감도가 높은 여성들이 에스트로겐 수치가 낮은 것으로 나타났습니다. 이는 갱년기 여성들이 통증에 민감하다는 사실을 보여줍니다(2). 이와 더불어 이전의 갱년기 동물 모델을 사용한 연구에서도 von-Frey 필라멘트 실험을 통한 통증 반응 역치값의 감소가 관찰되었으며, 이는 갱년기에 통증 민감도가 증가하는 것을 의미합니다(19). 또한 갱년기 동물 모델에서는 열적 통각과민(thermal hyperalgesia)을 측정한 결과, 반응 시간(response latency)이 유의적으로 감소하며, 17β-estradiol 투여를 통해 이 반응 시간이 유의적으로 증가하는 것을 확인할 수 있었습니다(20).
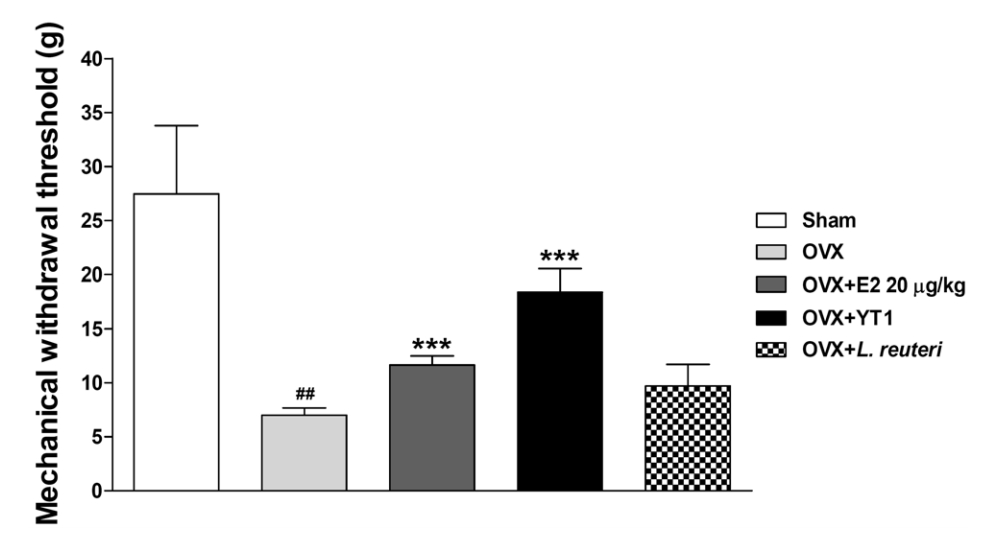
프로바이오틱스는 다양한 통증 모델에서 통증 완화에 도움을 준다는 연구 결과가 있습니다. 예를 들어, 비만으로 유도된 통증 모델에서 Lactobacillus rhamnosus PB01(DSM 14870)의 투여가 기계적 자극에 대한 통증 민감도를 감소시킨다고 보고되었으며(21), L. acidophilus를 함유하는 유산균 배양액(bacterial extracts)이 화학요법 유도 신경병증성 통증 동물모델에서 통증 민감도를 완화시킨다는 보고가 있습니다(22). 이러한 연구 결과를 고려하면, 본 연구를 통해 프로바이오틱스가 비만 유도 통증이나 화학요법 유도 신경병증성 통증 뿐만 아니라 갱년기 동물 모델에서도 통증 민감도를 감소시킬 수 있음을 확인하였습니다.
YT1 투여를 통한 우울증 관련 증상 완화
본 연구에서는 갱년기 동물 모델에 대하여 12주 동안 다양한 처리를 시행한 후 우울증 유사 행동을 확인하였습니다(Fig. 2). 결과적으로, OVX 그룹에서는 Sham 그룹에 비해 우울증 상태를 나타내는 부동시간이 유의적으로 증가하였습니다(P<0.001). 그러나 estradiol 투여 그룹과 L. acidophilus YT1 투여 그룹에서는 OVX 그룹에 비해 부동시간이 유의적으로 감소하였습니다(P<0.05). 이는 L. acidophilus YT1의 투여가 갱년기 동물 모델에서 우울증 증상을 완화시킬 수 있음을 시사합니다.
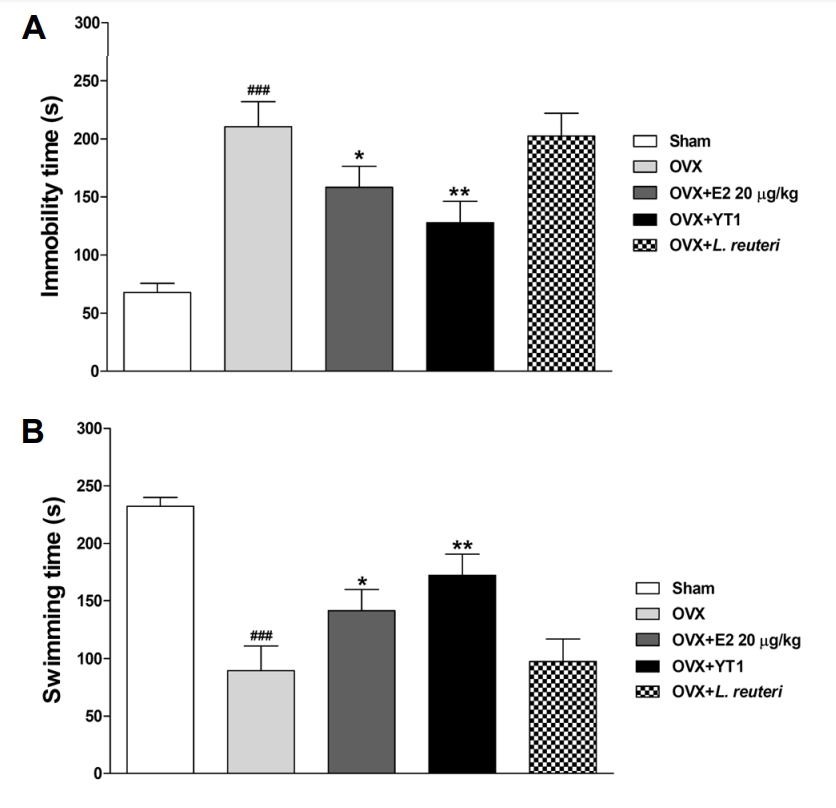
우울증은 갱년기 여성들에게 흔히 나타나는 증상 중 하나로, 에스트로겐 농도의 감소와 관련하여 심리적인 변화가 나타납니다(3). 이와 관련하여 갱년기 동물 모델에서도 우울증 유사 행동이 나타나며, 자당용액 섭취 검사, 강제수영 실험, 꼬리 매달기 등을 통해 확인된 우울증 유사 행동은 estradiol 투여를 통해 완화될 수 있습니다(23, 24).
또한 인간을 대상으로 한 임상 연구에서는 특정 프로바이오틱스 성분인 L. acidophilus, L. casei, Bifidobacterium bifidum이 혼합된 캡슐의 섭취가 주요 우울장애를 겪는 환자의 우울증을 완화시킬 수 있으며, L. acidophilus 및 기타 7종의 프로바이오틱스를 포함한 요거트 섭취가 정신건강에 도움을 준다는 연구 결과도 있습니다(25, 26). 또한 모체 분리로 유발된 우울증 동물 모델에서는 Bifidobacterium infantis의 투여가 항우울 효능을 나타내었습니다(27).
이번 연구를 통해 프로바이오틱스가 난소 절제로 유발된 동물의 우울증 유사 행동을 완화시킬 수 있으며, 특히 L. acidophilus YT1과 같은 특정 미생물이 갱년기의 우울증을 완화할 수 있음을 확인하였습니다.
YT1 투여를 통한 골밀도 증가
갱년기 모델 동물의 12주 후 골밀도 측정 결과(Fig. 3), OVX 그룹에서는 Sham 그룹에 비해 골밀도가 유의적으로 감소하였습니다(P<0.05). 그러나 estradiol 투여 그룹과 YT1 투여 그룹에서는 OVX 그룹에 비해 골밀도가 유의적으로 증가하였습니다(P<0.05). 이를 통해 난소 절제로 인한 골밀도 감소가 L. acidophilus YT1 투여를 통해 완화됨을 확인하였습니다.
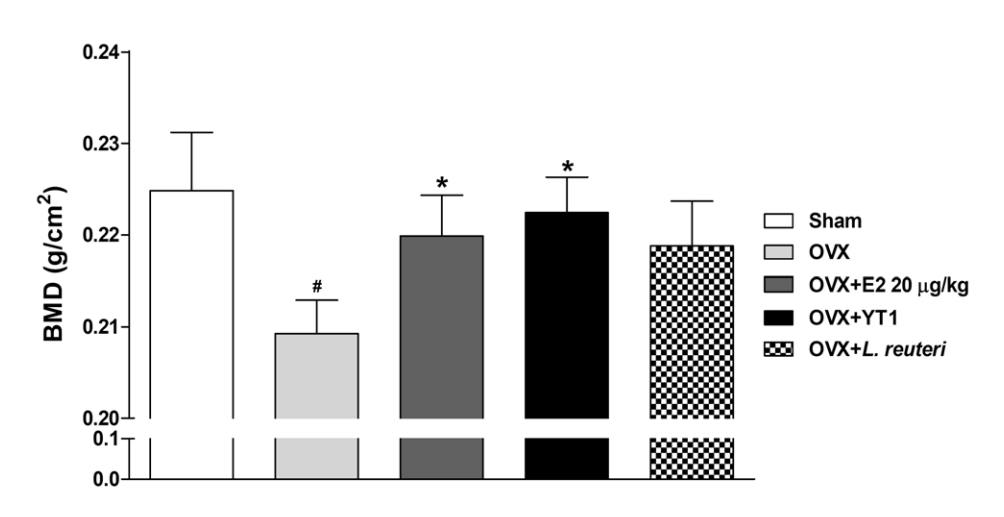
여성의 골량은 대략 30대에 최고치에 달하며, 이후로는 골흡수와 골형성이 균형을 유지하며 교체되는 재형성 과정을 통해 유지됩니다. 특히 폐경기 이후에는 골형성이 골흡수보다 적게 일어나 골량이 감소합니다(4). 갱년기에 발생하는 골손실은 에스트로겐 농도와 연관되며, 국내 연구에 따르면 에스트로겐 투여를 통해 골밀도가 증가한다고 보고되었습니다(28, 29).
갱년기 동물 모델에서도 골밀도의 감소가 보고되며, 이러한 골밀도의 감소는 estradiol 투여를 통해 유의적으로 증가하는 것으로 알려져 있습니다(30). 프로바이오틱스의 투여가 골밀도를 증가시킨다는 것은 이전 연구에서도 확인되었습니다. 난소 절제로 인해 골밀도가 감소하는 동물 모델에서 Bifidobacterium longum(31) 및 L. reuteri(32)의 투여가 골밀도의 증가와 관련되어 있음이 보고되었습니다.
YT1 투여를 통한 체중과 체지방 변화
갱년기 여성들의 체중과 체지방의 증가는 우울증뿐만 아니라 골다공증 발병과도 관련이 있습니다(33). 이러한 증가된 체중은 호르몬 대체 요법을 통해 일정 정도 완화할 수 있다는 것이 알려져 있습니다. 갱년기 동물 모델에서도 체중이 증가하는 경향을 보이며, 에스트로겐 투여 시 체중이 감소하며 이러한 작용은 에스트로겐 알파 수용체를 통해 일어납니다(34, 35). 식물성 에스트로겐도 에스트로겐과 유사하게 갱년기에서 증가된 체중을 감소시킬 수 있으며, 특히 이소플라본(isoflavones)의 투여가 체중을 감소시킨다는 연구 결과가 있습니다(36, 37).
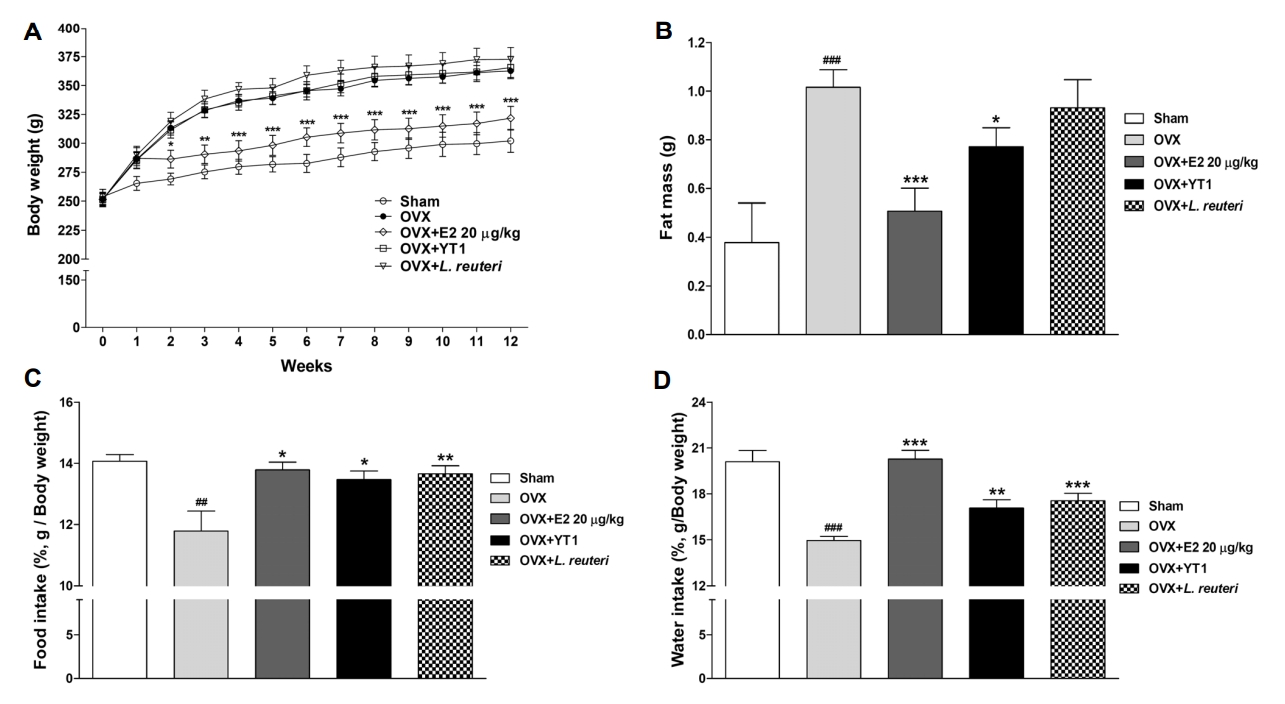
본 실험에서는 난소절제로 인해 갱년기 모델을 유도한 후 Sham 그룹과 비교하여 체중이 급격히 증가함을 확인하였습니다. 그러나 estradiol 투여 그룹에서는 이러한 체중 증가가 감소하였으며, 프바이오틱스 처리 그룹에서는 체중 변화가 나타나지 않았습니다(Fig. 4A).
체지방 측정에서는 OVX 그룹(1.016±0.07 g)이 Sham 그룹(0.3783±0.16 g)에 비해 유의적으로 체지방이 증가하였으며(P<0.001), estradiol 투여 그룹(0.5077±0.09 g)과 L. acidophilus YT1 투여 그룹(0.7710±0.08 g)에서는 증가한 체지방이 감소함을 확인하였습니다(P<0.001, P<0.05, Fig. 4B).
또한 사료 및 식수 섭취량을 랫트의 무게로 나눈 결과(Fig. 4C, 4D), OVX 그룹(14.95±0.2675%)에서는 Sham 그룹(20.1±0.7425%)에 비해 식수 섭취량/무게 값이 유의적으로 감소하였으며(P<0.001), estradiol 투여 그룹(20.28±0.5741%)과 YT1 투여 그룹(17.07±0.5458%)에서는 OVX 그룹 대비 유의적으로 증가하였습니다(P<0.001, P<0.01).
이러한 결과는 OVX로 인해 갱년기 유도 시 증가한 체중에 비해 사료 섭취량이 감소(38, 39)하고 식수 섭취량도 감소(40)하였다는 다른 연구들과 일치합니다. Cengiz 등은 L. acidophilus를 포함한 프로바이오틱스를 투여하였을 때 사료 섭취량이 증가하였으며 FCR(feed conversion ratio)에는 변화가 없었다고 밝혔습니다(41). 본 연구에서도 L. acidophilus YT1 투여 후에 사료 섭취량이 증가하였습니다.
또한 갱년기 동물모델에 L. paracasei를 포함한 프로바이오틱스를 투여하였을 때 골밀도는 증가하지만 체중 변화가 없다는 것이 보고되었습니다(42). 최근 성 호르몬 부족에 따른 골밀도 저하에 있어 장내미생물의 역할에 대한 연구가 활발히 진행되고 있습니다.
성 호르몬 부족은 장 투과도(gut permeability)를 증가시키고 TNF-α, RANKL 및 IL-17과 같은 파골세포성 사이토카인(osteoclastogenic cytokine) 생성을 증가시킵니다. 그러나 무균 마우스에서는 이러한 파골세포성 사이토카인이 증가하지 않으며, 프로바이오틱스에 의해 골손실을 예방할 수 있다는 연구가 발표되었습니다(43). 이로 미루어 볼 때 장내미생물군이 성 호르몬 결핍에 의해 발생하는 골손실에 중요한 역할을 하고 있음을 알 수 있으며, L. acidophilus YT1의 갱년기 증상 완화 효능도 이와 관련되어 있을 것으로 생각됩니다.
YT1 처리에 의한 장벽 기능 강화
성 스테로이드인 에스트로겐의 결핍은 장내 투과성을 증가시킬 수 있으며(43), 장관의 특정 부위나 에스트로겐 결핍 시기에 따라 장내 투과성 변화에 영향을 미친다고 보고되었습니다(44). 장내 투과성은 섭취한 식품이나 의약품에 의해서도 영향을 받을 수 있습니다. 경구로 섭취된 유산균은 소화기관을 거쳐 장에서 일정 기간 동안 머무르며, 이는 인체 장관 상피세포와의 직접적인 접촉을 통해 장내 투과성 변화에 영향을 줄 수 있습니다.
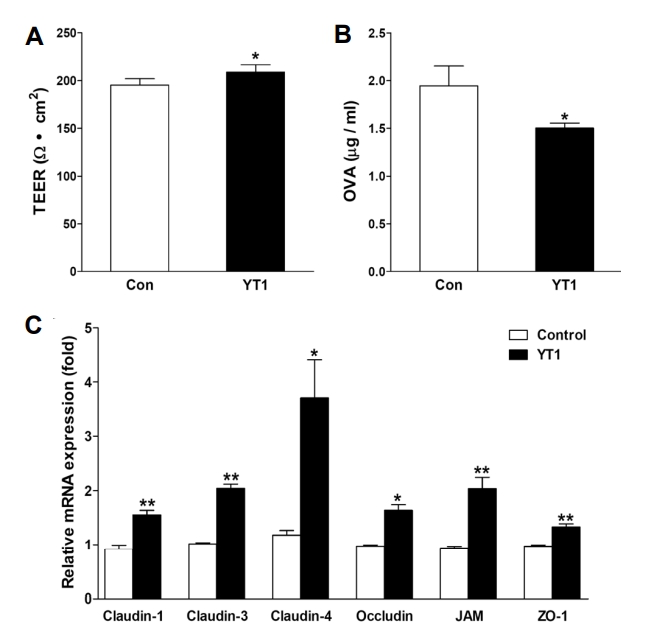
본 연구에서는 Caco-2 단세포층을 사용하여 L. acidophilus YT1의 장내 투과성 관련 지표에 미치는 영향을 확인하기 위해 TEER(세포 간의 전기 저항치) 측정과 OVA 단백질의 통과량을 분석하였습니다. L. acidophilus YT1 미처리 그룹(195.3±6.629 Ω・cm2)에 비해 L. acidophilus YT1 처리 그룹(209±7.739 Ω・cm2)에서 TEER 수치가 유의적으로 증가하였으며(P<0.05), OVA 단백질의 통과량이 1.945±0.207 μg/mL에서 1.511±0.0532 μg/mL로 유의적으로 감소한 것을 확인하였습니다(P<0.05, Fig. 5A, 5B). 이러한 TEER의 증가는 장관 상피세포의 세포 간 밀착성이 L. acidophilus YT1에 의해 증가한 것을 의미합니다. 이를 통해 단백질 통과 억제에도 영향을 준 것으로 보입니다.
장벽의 투과성은 세포 간의 밀착도에 따라 조절되며, 이를 위해 다양한 단백질들이 복합체를 형성하여 Tight junction을 구성하고 조절합니다(46). 본 연구에서는 L. acidophilus YT1 처리로 인해 Tight junction의 주요 유전자 발현량이 유의적으로 증가한 것을 확인하였습니다(Fig. 5C).
위의 실험 결과를 통해 L. acidophilus YT1이 Tight junction 유전자 발현 상향조절을 통해 장벽 기능을 강화시킴을 확인할 수 있었습니다. 이러한 L. acidophilus YT1의 활성은 성 호르몬 결핍으로 인해 장내 투과성이 증가하는 것을 예방하고 회복하는 데에도 적용할 수 있을 것으로 판단됩니다.
갱년기(폐경)는 나이가 들면서 난소의 노화로 인해 생식 호르몬의 생산이 감소하는 자연스러운 신체적 변화 과정이며, 이에 따라 수반되는 증상으로 인해 삶의 질이 저하될 수 있습니다. 갱년기 증상 완화를 위해 주로 호르몬 대체 요법이 사용되지만, 장기간 사용 시 부작용이 발생할 수 있어 새로운 치료법이 필요합니다.
프로바이오틱스는 장 건강, 비만, 면역 등에 유익한 효과로 잘 알려져 있으며, 최근 연구에서는 갱년기에도 유용한 효과가 있다고 보고되고 있습니다. 이에 본 연구에서는 난소절제 동물모델을 사용하여 Lactobacillus acidophilus YT1이 갱년기 증상에 미치는 효능을 확인하였습니다. 실험 결과에 따르면 L. acidophilus YT1 투여 그룹에서는 통증 민감도, 우울증 관련 행동, 체지방량의 증가, 골밀도의 감소와 같은 갱년기 증상이 유의하게 개선되었습니다.
또한, L. acidophilus YT1은 장 상피세포의 장벽 강화를 통해 장내 투과성을 강화시킬 수 있었습니다. 이를 통해 L. acidophilus YT1은 갱년기 여성의 건강을 위한 효과적인 옵션으로 고려될 수 있습니다. 추가적인 연구를 통해 갱년기 여성을 위한 건강 기능성 식품의 개발이 가능할 것으로 기대됩니다.
이상 갱년기 유산균 YT1, 실험 근거 정리하여 안내해 드렸습니다.
아래의 링크는 갱년기 증상 완화에 관한 정보로 함께 확인 하면 도움을 주는 “갱년기 증상 완화, 건강한 장내 세균총의 역할”을 확인하실 수 있습니다.
REFERENCES
- Monteleone P, Mascagni G, Giannini A, Genazzani AR, Simoncini T. 2018. Symptoms of menopause-global prevalence, physiology and implications. Nat Rev Endocrinol 14: 199-215.
- Nikolov V, Petkova M. 2010. Pain sensitivity among women with low estrogen levels. Procedia Soc Behav Sci 5: 289-293.
- Perez-Lopez FR, Perez-Roncero G, Fernandez-Inarrea J, Fernandez-Alonso AM, Chedraui P, Llaneza P. 2014. Resilience, depressed mood, and menopausal symptoms in postmenopausal women. Menopause 21: 159-164.
- Sasson H, Carpenter CL. 2013. Achievement of peak bone mass in women is critically dependent on adolescent calcium intake. OA Sports Medicine 1: 16.
- Davison S, Davis SR. 2003. Hormone replacement therapy: current controversies. Clin Endocrinol 58: 249-261.
- Tavani A, La Vecchia C. 1999. The adverse effects of hormone replacement therapy. Drugs Aging 14: 347-357.
- Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, Jackson RD, Beresford SA, Howard BV, Johnson KC, Kotchen JM, Ockene J. 2002. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA 288: 321-333.
- Kang SJ, Choi BR, Kim SH, Yi HY, Park HR, Song CH, Ku SK, Lee YJ. 2017. Anti-climacterium effects of pomegranate concentrated solutions in ovariectomized ddY mice. Exp Ther Med 13: 1249-1266.
- Wang L, Guo MJ, Gao Q, Yang JF, Yang L, Pang XL, Jiang XJ. 2018. The effects of probiotics on total cholesterol: A meta-analysis of randomized controlled trials. Medicine 97: e9679.
- Al-Ghazzewi FH, Tester RF. 2014. Impact of prebiotics and probiotics on skin health. Benefic Microbes 5: 99-107.
- Stevens GA. 2016. Probiotics for digestive health: A review of information resources. J Consum Health Internet 20: 167- 172.
- Kober MM, Bowe WP. 2015. The effect of probiotics on immune regulation, acne, and photoaging. Int J Womens Dermatol 1: 85-89.
- Torii S, Torii A, Itoh K, Urisu A, Terada A, Fujisawa T, Yamada K, Suzuki H, Ishida Y, Nakamura F, Kanzato H, Sawada D, Nonaka A, Hatanaka M, Fujiwara S. 2011. Effects of oral administration of Lactobacillus acidophilus L-92 on the symptoms and serum markers of atopic dermatitis in children. Int Arch Allergy Immunol 154: 236-245.
- Bull M, Plummer S, Marchesi J, Mahenthiralingam E. 2013. The life history of Lactobacillus acidophilus as a probiotic: a tale of revisionary taxonomy, misidentification and commercial success. FEMS Microbiol Lett 349: 77-87.
- Dar HY, Shukla P, Mishra PK, Anupam R, Mondal RK, Tomar GB, Sharma V, Srivastava RK. 2018. Lactobacillus acidophilus inhibits bone loss and increases bone heterogeneity in osteoporotic mice via modulating Treg-Th17 cell balance. Bone Rep 8: 46-56.
- Montazeri-Najafabady N, Ghasemi Y, Dabbaghmanesh MH, Talezadeh P, Koohpeyma F, Gholami A. 2018. Supportive role of probiotic strains in protecting rats from ovariectomyinduced cortical bone loss. Probiotics Antimicrob Proteins 1-10.
- Heiss C, Govindarajan P, Schlewitz G, Hemdan NYA, Schliefke N, Alt V, Thormann U, Lips KS, Wenisch S, Langheinrich AC, Zahner D, Schnettler R. 2012. Induction of osteoporosis with its influence on osteoporotic determinants and their interrelationships in rats by DEXA. Med Sci Monit 18: BR199-207.
- Chaplan SR, Bach FW, Pogrel JW, Chung JM, Yaksh TL. Quantitative assessment of tactile allodynia in the rat paw. J Neurosci Methods 53: 55-63.
- Li LH, Wang ZC, Yu J, Zhang YQ. 2014. Ovariectomy results in variable changes in nociception, mood and depression in adult female rats. PLoS One 9: e94312.
- Sanoja R, Cervero F. 2008. Estrogen modulation of ovariectomy-induced hyperalgesia in adult mice. Eur J Pain 12: 573-581.
- Dardmeh F, Nielsen HI, Alipour H, Kjærgaard B, Brandsborg E, Gazerani P. 2016. Potential nociceptive regulatory effect of probiotic Lactobacillus rhamnosus PB01 (DSM 14870) on mechanical sensitivity in diet-induced obesity model. Pain Res Manag 2016: 5080438.
- Castelli V, Palumbo P, d’Angelo M, Moorthy NK, Antonosante A, Catanesi M, Lombardi F, Iannotta D, Cinque B, Benedetti E, Ippoliti R, Cifone MG, Cimini A. 2018. Probiotic DSF counteracts chemotherapy induced neuropathic pain. Oncotarget 9: 27998-28008.
- Wang Y, Xu Y, Sheng H, Ni X, Lu J. 2016. Exercise amelioration of depression-like behavior in OVX mice is associated with suppression of NLRP3 inflammasome activation in hippocampus. Behav Brain Res 307: 18-24.
- Sasayama D, Sugiyama N, Yonekubo S, Pawlak A, Murasawa H, Nakamura M, Hayashi M, Ogawa T, Moro M, Washizuka S, Amano N, Hongo K, Ohnota H. 2017. Novel oestrogen receptor β-selective ligand reduces obesity and depressive-like behaviour in ovariectomized mice. Sci Rep 7: 4663.
- Akkasheh G, Kashani-Poor Z, Tajabadi-Ebrahimi M, Jafari P, Akbari H, Taghizadeh M, Memarzadeh MR, Asemi Z, Esmaillzadeh A. 2016. Clinical and metabolic response to probiotic administration in patients with major depressive disorder: A randomized, double-blind, placebo-controlled trial. Nutrition 32: 315-320.
- Mohammadi AA, Jazayeri S, Khosravi-Darani K, Solati Z, Mohammadpour N, Asemi Z, Adab Z, Djalali M, TehraniDoost M, Hosseini M, Eghtesadi S. 2016. The effects of probiotics on mental health and hypothalamic-pituitary-adrenal axis: A randomized, double-blind, placebo-controlled trial in petrochemical workers. Nutr Neurosci 19: 387-395.
- Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan JF, Dinan TG. 2010. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression. Neuroscience 170: 1179-1188. Hedlund LR, Gallagher JC. 1989. The effect of age and menopause on bone mineral density of the proximal femur. J Bone Miner Res 4: 639-642.
- Kim HJ, Oh YK, Lee JS, Lee DY, Choi DS, Yoon BK. 2014. Effect of transdermal estrogen therapy on bone mineral density in postmenopausal Korean women. J Menopausal Med 20: 111-117.
- Lim DW, Kim YT. 2014. Anti-osteoporotic effects of Angelica sinensis (Oliv.) Diels extract on ovariectomized rats and its oral toxicity in rats. Nutrients 6: 4362-4372.
- Parvaneh K, Ebrahimi M, Sabran MR, Karimi G, Hwei ANM, Abdul-Majeed S, Ahmad Z, Ibrahim Z, Jamaluddin R. 2015. Probiotics (Bifidobacterium longum) increase bone mass density and upregulate Sparc and Bmp-2 genes in rats with bone loss resulting from ovariectomy. Biomed Res Int 2015: 897639.
- Britton RA, Irwin R, Quach D, Schaefer L, Zhang J, Lee T, Parameswaran N, McCabe LR. 2014. Probiotic L. reuteri treatment prevents bone loss in a menopausal ovariectomized mouse model. J Cell Physiol 229: 1822-1830.
- Davis SR, Castelo-Branco C, Chedraui P, Lumsden MA, Nappi RE, Shah D, Villaseca P. 2012. Understanding weight gain at menopause. Climacteric 15: 419-429.
- Chmouliovsky L, Habicht F, James RW, Lehmann T, Campana A, Golay A. 1999. Beneficial effect of hormone replacement therapy on weight loss in obese menopausal women. Maturitas 32: 147-153.
- Bhardwaj P, Du B, Zhou XK, Sue E, Giri D, Harbus MD, Falcone DJ, Hudis CA, Subbaramaiah K, Dannenberg AJ.
- Estrogen protects against obesity induced mammary gland inflammation in mice. Cancer Prev Res (Phila) 8: 751- 759.
- Chen YM, Ho SC, Lam SSH, Ho SSS, Woo JLF. 2004. Beneficial effect of soy isoflavones on bone mineral content was modified by years since menopause, body weight, and calcium intake: a double-blind, randomized, controlled trial. Menopause 11: 246-254.
- Zhang YB, Chen WH, Guo JJ, Fu ZH, Yi C, Zhang M, Na XL. 2013. Soy isoflavone supplementation could reduce body weight and improve glucose metabolism in non-Asian postmenopausal women-A meta-analysis. Nutrition 29: 8- 14.
- Sanchez-Mateos S, Alonso-Gonzalez C, Gonzalez A, Martinez-Campa CM, Mediavilla MD, Cos S, Sanchez-Barcelo EJ. 2007. Melatonin and estradiol effects on food intake, body weight, and leptin in ovariectomized rats. Maturitas 58: 91-101.
- Rogers NH1, Perfield JW 2nd, Strissel KJ, Obin MS, Greenberg AS. 2009. Reduced energy expenditure and increased inflammation are early events in the development of ovariectomy-induced obesity. Endocrinology 150: 2161-2168.
- Pettipher ER, Hibbs TA, Smith MA, Griffiths RJ. 1997. Analgesic activity of 2-amino-4-methylpyridine, a novel NO
synthase inhibitor. Inflamm Res 46: S135-136. - Cengiz O, Koksal BH, Tatli O, Sevim O, Ahsan U, Uner AG, Ulutas PA, Beyaz D, Buyukyoruk S, Yakan A, Onol AG. 2015. Effect of dietary probiotic and high stocking density on the performance, carcass yield, gut microflora, and stress indicators of broilers. Poult Sci 94: 2395-2403.
- Ohlsson C, Engdahl C, Fåk F, Andersson A, Windahl SH, Farman HH, Movérare-Skrtic S, Islander U, Sjögren K. 2014. Probiotics protect mice from ovariectomy-induced cortical bone loss. PLoS One 9: e92368.
- Li JY, Chassaing B, Tyagi AM, Vaccaro C, Luo T, Adams J, Darby TM, Weitzmann MN, Mulle JG, Gewirtz AT, Jones RM, Pacifici R. 2016. Sex steroid deficiency-associated bone loss is microbiota dependent and prevented by probiotics. J Clin Invest 126: 2049-2063.
- Braniste V, Leveque M, Buisson-Brenac C, Bueno L, Fioramonti J, Houdeau E. 2009. Oestradiol decreases colonic permeability through oestrogen receptor β-mediated up-regulation of occludin and junctional adhesion molecule-A in epithelial cells. J Physiol 587: 3317-3328.
- Ward PD, Tippin TK, Thakker DR. 2000. Enhancing paracellular permeability by modulating epithelial tight junctions. Pharm Sci Technolo Today 3: 346-358.
- Forster C. 2008. Tight junctions and the modulation of barrier function in disease. Histochem Cell Biol 130: 55-70.